近年来,含溶瘤病毒疗法和过继T细胞疗法在内的新型免疫治疗方法引起了广泛的关注。溶瘤病毒疗法是利用能够选择性在肿瘤细胞内大量复制的病毒摧毁肿瘤细胞。在此过程中,所激发免疫反应以招募更多的免疫细胞继续杀死残余的肿瘤细胞。溶瘤病毒疗法有很多优点,如针对性强、副作用小、免疫效应强、易于修饰和改造等。然而,溶瘤病毒来源的治疗方法也面临着一些挑战,如何有效地将溶瘤病毒输送到肿瘤部位,以及如何克服肿瘤微环境的免疫抑制作用是目前该疗法亟需解决的问题。

2024年2月9日,良渚实验室\浙江大学药学院平渊团队(良渚实验室科研楼2C区域)在Nature Biotechnology杂志发表题为“An Oncolytic Virus–T cell Chimera for Cancer Immunotherapy”的研究论文,开发了一种名为ONCOTECH的递送技术(溶瘤病毒-T细胞嵌合体),用以同时增强溶瘤病毒的靶向输送和改善肿瘤微环境。该研究为肿瘤治疗提供了一种新的思路和方法,也为溶瘤病毒治疗的临床应用开辟了新的可能性。
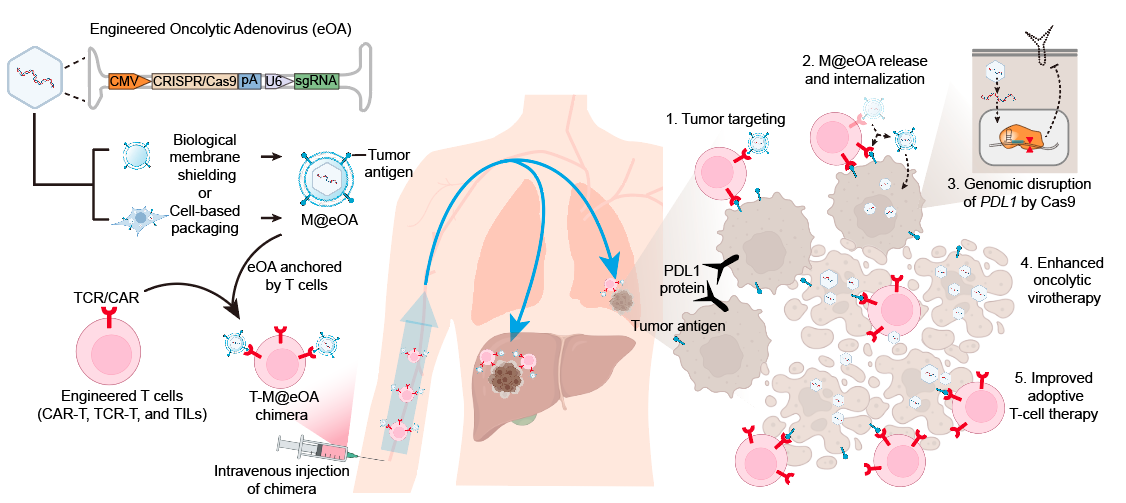
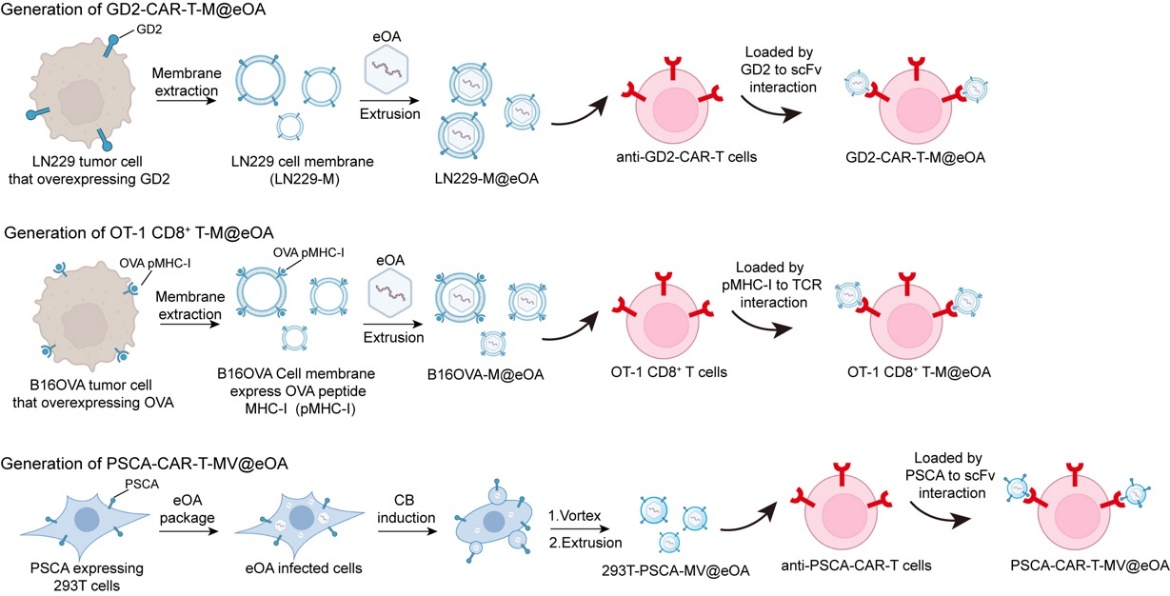
研究人员首先通过构建了一个表达Cas9基因编辑系统的溶瘤腺病毒,并使用含有特定抗原表达的生物膜对该溶瘤腺病毒进行包被,最后通过T细胞表面的T细胞受体携带膜包被的基因编辑溶瘤腺病毒(命名为eOA)。该研究发现,T细胞能够增强eOA的实体瘤靶向输送,通过在瘤内基因编辑PD-L1基因改善肿瘤微环境,可以同时增强溶瘤病毒疗法和过继T细胞疗法的实体瘤治疗。 图1 基因编辑溶瘤病毒-T细胞嵌合体 用于增强溶瘤病毒疗法和过继T细胞疗法的示意图 研究人员首先通过构建了一个能够编码Cas9基因编辑系统的溶瘤腺病毒,包裹在一个表达T细胞特异性抗原的生物膜中,并使用含有特定抗原表达的生物膜对该溶瘤腺病毒进行包被,然后将这些膜伪装的溶瘤病毒通过识别T细胞受体或嵌合抗原受体的方式物理地附着在T细胞的表面(命名为eOA)。这种锚定策略不会影响T细胞的功能,而且一旦携带溶瘤病毒的T细胞到达肿瘤细胞并识别出它们的特异性抗原,溶瘤腺病毒就会被释放出来,并感染肿瘤细胞。更为重要的是,由于溶瘤病毒疗法和过继T细胞疗法都会在实体瘤内造成PD-L1的高表达,从而逃避免疫监控和T细胞的进一步杀伤。而基因编辑溶瘤腺病毒中携带的Cas9编辑器能够靶向敲除肿瘤细胞和肿瘤内的免疫抑制细胞中的PDL1基因,降低它们的PD-L1表达水平,从而逆转肿瘤微环境的免疫抑制作用,这有利于T细胞治疗和溶瘤病毒的肿瘤溶解作用。 研究人员提取表达OVA的肿瘤细胞膜对eOA进行包被,再使用OT-1鼠来源的OVA靶向的CD8+ T细胞携带膜包被的eOA,作为第一代ONCOTECH技术进行了一系列的鼠源肿瘤模型的验证实验,包括小鼠皮肤癌皮下、复发和转移模型以及小鼠乳腺癌模型。为了进一步推进临床转化,研究人员使用了表达特定抗原的HEK293细胞作为生产细胞,通过溶瘤病毒感染生产细胞后,分离出含溶瘤病毒的微囊泡,再利用这些微囊泡表面的特定抗原与CAR-T细胞表面的抗原嵌合受体结合,作为第二代的ONCOTECH技术,并在具有人免疫系统的人源化小鼠进行了靶向效率及疗效验证,包括人原位脑瘤模型、人原位肺癌、人胰腺癌PDX模型。研究结果表明,ONCOTECH能够有效地抑制多种类型的肿瘤生长,包括皮肤癌、乳腺癌、肺癌等,并且比单独使用肿瘤溶病毒或T细胞治疗更有效。此外,ONCOTECH也能够诱导肿瘤的长期免疫记忆,防止肿瘤的复发。该研究为溶瘤病毒静脉靶向递送及克服肿瘤免疫抑制微环境提供了策略,并为溶瘤细胞与T细胞的联合疗法的临床转化提供改了新思路。 图2 ONCOTECH技术的构建步骤与原理 良渚实验室\浙江大学药学院平渊教授为该论文唯一通讯作者。浙江大学博士生陈宇轩及陈小红博士为该论文共同第一作者,合作者包括中国科学院过程工程研究所魏炜研究员及厦门大学刘刚教授。近年来,平渊实验室开发了多种基因编辑工具的递送方法,在动物模型上成功用于肿瘤、炎症性疾病的治疗。相关工作相继发表于PNAS (2020)、Sci. Adv. (2021a)、Sci. Adv. (2021b)、Adv. Mater. (2021)、ACS Cent. Sci. (2021)、Signal Transduct. Target. Ther. (2022)、Nat. Nanotechnol. (2023)、Acc. Chem. Res. (2023)、Angew. Chem. Int. Ed. (2024)等期刊上。该工作得到国家重点研发计划项目等基金支持。 招聘 平渊,良渚实验室课题组长,浙江大学长聘教授,博士生导师,浙江省特聘专家,遵义医科大学药学院院长(兼职)。主要研究方向为药物递送技术在基因编辑与生物大分子治疗领域的应用,近五年以通讯作者在Nature Biotechnology, Nature Nanotechnology, Nature Chemistry, PNAS, Science Advances, Angewandte Chemie International Edition, Advanced Materials等杂志发表论文40余篇。曾获得JCR Emerging Leader Award、国际先进材料学会科学家奖章及浙江大学十大学术进展提名等。任Journal of Controlled Release、Synthetic and Systems Biotechnology、Asian Journal of Pharmaceutical Sciences及《自然综述:药物发现》杂志中文版编委。目前主持了多项国际、国家及地区基金。 因实验室发展需要,现招聘有机合成、药学、分子生物学、遗传学等研究领域的博士后1-2名。岗位要求:工作细致,有较强的独立科研能力、执行能力,及组织协调能力。有意向者请将个人简历发送至pingy@zju.edu.cn(备注“职位+姓名”)。