
新年伊始,良渚实验室血液与免疫疾病领域首席科学家黄河教授与团队PI肖刚研究员以及钱鹏旭研究员课题组合作在学术期刊Cell Metabolism上发表研究论文Mitochondrial isocitrate dehydrogenase impedes CAR T-cell function by restraining antioxidant metabolism and histone acetylation。
该研究通过CAR T细胞的分化与功能检测体系,首次借助线粒体相关小分子抑制剂筛选鉴定了线粒体异柠檬酸脱氢酶2(isocitrate dehydrogenase 2, IDH2)是CAR T细胞代谢适应性和功能持久性的关键调节因子。
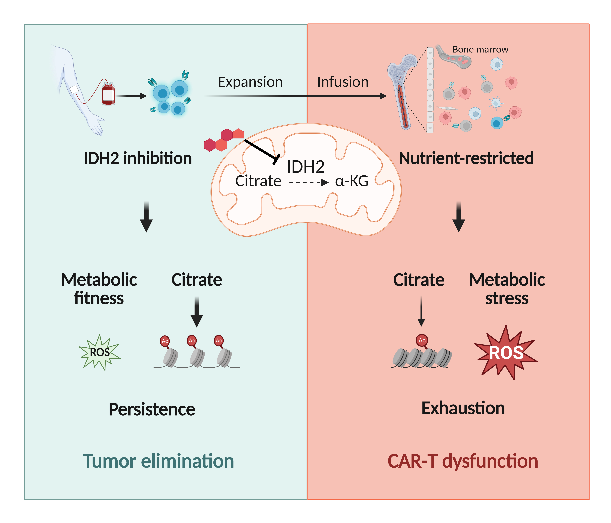
已知IDH2作为关键代谢因子控制了细胞氧化/还原型三羧酸循环的进行,从而为细胞的高速增殖及功能活化提供能量与物质的保证。该合作研究则发现,IDH2活性的阻断能够促进记忆型CAR T细胞分化,减少耗竭,使CAR T细胞在体内发挥更持久的肿瘤杀伤效能。进一步研究证实,在营养物质可及性急剧下降的代谢微环境中,使用临床获批的靶向药物可以显著增强CAR T细胞的代谢稳健性(Metabolic Robustness)进一步促进对血液肿瘤、实体肿瘤的杀伤。
IDH2位于线粒体中,以NADP+为辅因子,催化三羧酸循环中异柠檬酸可逆转化为α-酮戊二酸。通过基因敲降或靶向药物阻断IDH2的活性可以重塑CAR T细胞中心碳代谢模式与表观遗传调控,增加CAR T细胞的抗肿瘤能力。
CD19-41BBζ-CAR,CD19-28ζ-CAR和GD2-28ζ-CAR介导的血液与实体肿瘤杀伤模型均证实了抑制IDH2可以增强CAR T细胞在体内的抗肿瘤能力和持久性。多组学联用与细胞代谢活性检测证实了IDH2活性抑制显著地降低了糖酵解水平,将CAR T细胞中的葡萄糖利用从糖酵解转向磷酸戊糖途径(pentose phosphate pathway, PPP),从而积累更高比例的NADPH和GSH,以降低ROS水平,有效抑制了CAR T细胞的耗竭。线粒体与胞质组分中柠檬酸和乙酰辅酶A(acetyl-CoA)水平的检测,证实了IDH2活性抑制通过阻断其介导的氧化脱羧反应,导致柠檬酸在胞质中的累积,直接增加acetyl-CoA和组蛋白乙酰化的水平;CUT&Tag-seq和RNA-seq联合分析证实表观遗传修饰的改变介导了转录重编程,促进记忆T细胞的形成,增强了CAR T细胞的扩增能力和持久存续。
该研究还发现,CAR T细胞经历了从体外高葡萄糖环境到体内葡萄糖匮乏的压力,导致了其终末分化和功能损伤,而IDH2的抑制能够促进CAR T细胞在低葡萄糖压力下的代谢稳健性与肿瘤杀伤功能。
目前,代谢模式对于T细胞命运决定的调控功能已经得到广泛认可。如何精准靶向代谢调控的节点,从而增强CAR T细胞的抗肿瘤效果并避免毒副作用,仍然是细胞免疫治疗领域的难题。该研究通过使用FDA批准的白血病临床用药恩西地平(Enasidenib)抑制CAR T细胞IDH2的活性,从机制上解析了线粒体关键代谢步骤对CAR T细胞命运决定的作用机制,为增强CAR T细胞的代谢适应性及治疗效果提供了具有安全保障的干预策略。
浙江大学博士后司晓慧,博士研究生邵谧、腾心怡、黄玥为该论文的共同第一作者。良渚实验室黄河教授,肖刚研究员,钱鹏旭研究员为该论文共同通讯作者。该研究受到浙江大学基础医学院、良渚实验室多个公共技术平台的大力支持,并受到中山大学黄蓬教授、良渚实验室裴善赡研究员和郭红山研究员的指导与帮助。 招聘 良渚实验室血液与免疫疾病领域黄河教授团队长期从事造血干细胞及细胞免疫治疗的基础与临床研究,近年来课题组在增强型免疫细胞治疗的开发、干细胞来源新型免疫细胞治疗的构建等方向展开创新研究;同时在免疫细胞治疗难治复发型血液系统恶性肿瘤、重大自身免疫疾病等的应用开展前沿性的技术开发。近期相关成果发表在Nature,The Lancet Haematology,Cell Research,Blood,Nature Communications等期刊,并展开多项国际领先的研究者发起、申办方发起的临床研究。 黄河教授团队现积极招聘特聘(副)研究员和博士后研究人员,诚挚邀请对血液恶性肿瘤、免疫治疗及造血分化研究感兴趣并具备一定基础的青年研究人员加入团队,有意者请将简历发送至:lixia2015@zju.edu.cn 原文链接:https://www.cell.com/cell-metabolism/fulltext/S1550-4131(23)00461-8



